Chronische Nierenerkrankungen
- DiaPat® RenOM Test
- Chronische Nierenerkrankungen
- Risikofaktoren für chronische Nierenerkrankungen
- Vorteile und Nutzen des DiaPat® RenOM Tests
- Das sagen Mediziner über den DiaPat® RenOM Test
- Probennahme des DiaPat® RenOM Tests
- Validierung des DiaPat® RenOM Tests
- Studien und Veröffentlichungen
DiaPat® RenOM Test
Durch die Analyse krankheitsspezifischer Proteine (Eiweiße) im Urin ermöglicht der DiaPat® RenOM Test die Früherkennung chronischer Nierenerkrankungen. Der Urintest wurde in klinischen Studien validiert. Er erkennt die Nierenschädigung zuverlässig - häufig bereits bevor dauerhafte Organschäden entstanden sind. Durch eine rechtzeitige Therapie können der vollständige Nierenfunktionsverlust und die dann erforderliche Nierenersatztherapie (Dialyse oder Nierentransplantation) hinausgezögert bzw. vermieden werden. Der RenOM Test kann eine Differenzierung zwischen den folgenden chronischen Nierenerkrankungen vornehmen:
- Minimal Change Disease (MCD)
- Membranöse Glomerulonephritis (MNGN)
- Fokal-segmentale Glomerulosklerose (FSGS)
- Immunglobulin-A-Nephropathie (IgA-Nephropathie)
- Systemischer Lupus Erythematodes (SLE)
- Vaskulitis
Chronische Nierenerkrankungen
Die Nieren befinden sich auf beiden Seiten der Wirbelsäule, sind etwa 12 cm lang und wiegen ca. 150 g. Zu ihren Hauptaufgaben gehören die Reinigung des Blutes und die Wasserausscheidung. Über das Blut werden Stoffwechselprodukte in die Nieren transportiert: giftige Produkte, so genannte harnpflichtige Substanzen, werden über den Urin ausgeschieden sowie für den Körper wichtige Stoffe über das Blut zurück in den Körper transportiert. Die Nieren bestehen hauptsächlich aus Filtereinheiten (Nephronen). Pro Tag werden dort mehr als 1.500 Liter Blut gefiltert. Wenn die Nieren geschädigt sind, können giftige Stoffe den Körper nicht mehr verlassen und verbleiben im Blut. In hoher Konzentration sind sie sehr schädlich. Darüber hinaus ist die Niere für die Bildung verschiedener Hormone zuständig, die unter anderem den Blutdruck und den Knochenstoffwechsel regulieren.
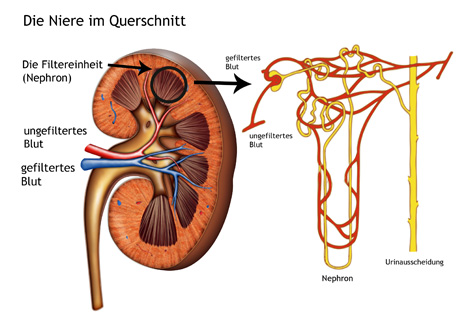
Die Schädigung der Nieren verläuft über einen langen Zeitraum ohne Symptome. Die Zerstörung des Nierengewebes ist jedoch irreversibel, und eine frühzeitige Diagnose daher entscheidend. Erst bei einer fortgeschrittenen Nierenschädigung treten Symptome wie Flüssigkeitsansammlungen, schäumender Urin durch die vermehrte Ausscheidung von Eiweiß, Juckreiz, Bluthochdruck sowie allgemeine Schwäche auf. Schmerzen in der Nierengegend treten bei chronischen Nierenerkrankungen nicht auf.
Können die Nieren ihre Funktion als Filter nicht mehr ausüben, besteht die Notwendigkeit der künstlichen Blutwäsche (Dialyse). Dazu wird der Patient an ein Dialysegerät angeschlossen, das über ein Schlauchsystem das Blut aus dem Körper pumpt und filtert. Das gereinigte Blut fließt anschließend zurück in den Körper. Die Dialysebehandlung ist mehrmals in der Woche notwendig. Dies kann über einige Jahre erfolgen, die Nierenfunktion kann aber auch die Dialyse nicht vollständig ersetzen. Langfristig ist eine Nierentransplantation notwendig.
Risikofaktoren für chronische Nierenerkrankungen
- Bluthochdruck (Hypertonie)
- Diabetes mellitus (Zuckerkrankheit)
- Nierenschädigende Medikamente
- Rauchen
- Alter 50+
- Erbliche Vorbelastung
Vorteile und Nutzen des DiaPat® RenOM Tests
Eine Chronische Nierenerkrankung (CKD) wird derzeit allein dadurch festgestellt, dass die Funktion der Nieren gemessen wird. Im Fokus steht dabei, wie gut die Nierenfilter (Glomeruli) noch arbeiten. Bei der Albuminurie wird die Menge des ausgeschiedenen Eiweißes „Albumin“ gemessen. Normalerweise wird das Albumin aufgrund seiner Größe von den Filtern der Niere zurückgehalten. Die bei einer CKD eintretenden massiven Schäden der Nierenfilter (im Bild dargestellt durch die Vergrößerung der Poren in der Membran) führen zunächst zum Austritt des Albumins in den Primärharn, wo es erst einmal im Tubulus resorbiert wird. Erst wenn dieses System „überflutet“ wird, tritt das Albumin mit dem auszuscheidenden Urin aus und kann gemessen werden. Daraus kann die Nierenfunktionsstörung bei einer CKD abgeleitet werden.
Auch die Verringerung der glomerulären Filtrationsrate (GFR) ist mit einem aus dem Blut gewonnenen Marker erst messbar, wenn die Funktion der Nierenfilter nur noch eingeschränkt ist.
Die Feststellung der CKD ist mit den beiden gängigen Funktionsparametern also erst möglich, wenn ein massiver Schaden an den Nieren bereits eingetreten ist. Erst dieser massive Nierenschaden von mindestens 50% des Organs bedingt die auf herkömmliche Art und Weise messbare Einschränkung der Nierenfunktion. Damit ist aber zumindest die Organreserve der Niere verloren gegangen.
Das bedeutet auch: Mit dem Beginn der Zerstörung der lebensnotwendigen Organfunktion über die Organreserve hinaus bleibt nur noch ein zeitlich sehr eingeschränkter Korridor, um den dynamischen Krankheitsverlauf zu verzögern. Maßgebliche Behandlungserfolge sind zu diesem Zeitpunkt nahezu ausgeschlossen.
DiaPat ermöglicht dagegen eine rechtzeitige CKD-Erkennung und damit ein erfolgreiches Behandlungsmanagement des Patienten. Für den behandelnden Arzt ergibt sich ein langer therapeutischer Zeitraum zur Anwendung der zugelassenen Medikamentierung und die Bestimmung der effizienten Dosierung, um den anfänglich nur langsamen fortschreitenden Erkrankungsprozess aufzuhalten oder gar zu stoppen.
Denn die Krankheitsentstehung liegt weit vor dem Verbrauch der Organreserve der Nieren. In der Regel treten die krankheitsbedingten Störungen immer zuerst auf molekularer Ebene auf. Erst dann manifestieren sich diese krankheitsspezifischen molekularen Strukturen im Gewebe bzw. im Organ, den Nieren.
Diese Krankheitsentstehung, ein definitiver Krankheitszustand, zeigt zu diesem frühen Zeitpunkt nur die Molekulardiagnostik von DiaPat an. Die Proteomanalyse erkennt mit einer revolutionären Technologie die früh stattfindende krankheitsbedingte Veränderung der Proteine im Körper aus einer Urinprobe.
Mit der Erkennung des Krankheitseintritts auf molekularer Ebene ist eine effizientere und erfolgreichere medikamentöse Behandlung des Patienten sichergestellt. Das leitet sich allein schon aus dem Wirkprinzip der zugelassenen Medikamente ab: Nahezu alle Medikamente wirken auf und mit Proteinen. Soll ein Medikament rechtzeitig und erfolgreich auf eine Erkrankung einwirken, wird das effektiv nicht mehr geschehen können, wenn Zellen des Organs respektive die Glomeruli abgestorben sind. Ein geschädigter oder abgestorbener Nierenfilter ist nicht mehr regenerierbar und damit auch nicht therapierbar. Therapierbar ist nur der molekulare Mechanismus der zur Nierenschädigung führt. Diesen gilt ist es medikamentös so zu steuern, dass die Schädigung der Nierenfilter bzw. deren Funktionsverfall gehemmt bzw. gestoppt wird. Allein daraus ergibt sich schon zwingend der Behandlungserfolg durch den Einsatz der Proteomanalyse.
Das sagen Mediziner über den DiaPat® RenOM Test
Professor Dr. Raymond Vanholder, Ghent University Hospital
"Chronische Nierenerkrankungen zeigen sich an Hand von Symptomen in der Regel erst sehr spät. Der DiaPat® RenOM Test ermöglicht die zuverlässige Diagnostik von Nierenschäden 3 bis 5 Jahre bevor erste Symptome auftreten."
Professor Hermann Haller, Klinik für Nieren- und Hochdruckerkrankungen, Medizinische Hochschule Hannover
"Auch die Ergebnisse der Therapie können mit dem DiaPat® RenOM Test optimal überwacht werden. Darüber hinaus wird die Differenzierung zwischen sechs verschiedenen Nierenerkrankungen ermöglicht, ohne dass es eingreifender Maßnahmen bedarf."
Probennahme des DiaPat® RenOM Tests
Der DiaPat® RenOM Test analysiert den Mittelstrahlurin. Für den Test wird der Mittelstrahl des zweiten Morgenurins in einem Urinbecher gesammelt. Anschließend wird der Urin in die beiliegende Urinmonovette* (Probenspritze) überführt und gekühlt. Für den Transport wird die Urinmonovette in eine Schutzverpackung* gesteckt. Der Versand in das Labor erfolgt per Overnight-Express.
* wird bereitgestellt.
Validierung des DiaPat® RenOM Tests
Der DiaPat® RenOM Test analysiert spezifische Proteine im Urin, die bereits sehr früh auf eine Nierenschädigung hinweisen. Mittels weiterer Proteinanalysen kann die Differentialdiagnose erfolgen. Die Diagnosemethode ist sehr zuverlässig* und wurde in klinischen Studien validiert.
* Sensitivität >85 %, Spezifität >85 %. Für weitere Informationen fragen Sie bitte Ihren Arzt.
Studien und Veröffentlichungen
Schanstra JP, Zürbig P, Alkhalaf A, Argiles A, Bakker SJ, Beige J, Bilo HJ, Chatzikyrkou C, Dakna M, Dawson J, Delles C, Haller H, Haubitz M, Husi H, Jankowski J, Jerums G, Kleefstra N, Kuznetsova T, Maahs DM, Menne J, Mullen W, Ortiz A, Persson F, Rossing P, Ruggenenti P, Rychlik I, Serra AL, Siwy J, Snell-Bergeon J, Spasovski G, Staessen JA, Vlahou A, Mischak H, Vanholder R.
Diagnosis and Prediction of CKD Progression by Assessment of Urinary Peptides.
J Am Soc Nephrol. 2015 Jan 14. pii: ASN.2014050423. [Epub ahead of print]
Gu YM, Thijs L, Liu YP, Zhang Z, Jacobs L, Koeck T, Zürbig P, Lichtinghagen R, Brand K, Kuznetsova T, Olivi L, Verhamme P, Delles C, Mischak H, Staessen JA.
The urinary proteome as correlate and predictor of renal function in a population study.
Nephrol Dial Transplant. 2014 Dec;29(12):2260-8. doi: 10.1093/ndt/gfu234. Epub 2014 Jun 30.
Argilés A, Siwy J, Duranton F, Gayrard N, Dakna M, Lundin U, Osaba L, Delles C, Mourad G, Weinberger KM, Mischak H.
CKD273, a New Proteomics Classifier Assessing CKD and Its Prognosis.
PLoS One. 2013 May 14;8(5):e62837. doi: 10.1371/journal.pone.0062837. Print 2013.
Kistler AD, Serra AL, Siwy J, Poster D, Krauer F, Torres VE, Mrug M, Grantham JJ, Bae KT, Bost JE, Mullen W, Wüthrich RP, Mischak H, Chapman AB.
Urinary proteomic biomarkers for diagnosis and risk stratification of autosomal dominant polycystic kidney disease: a multicentric study.
PLoS One. 2013;8(1):e53016. doi: 10.1371/journal.pone.0053016. Epub 2013 Jan 10.
Herget-Rosenthal S, Metzger J, Albalat A, Bitsika V, Mischak H.
Proteomic biomarkers for the early detection of acute kidney injury.
Prilozi. 2012 Jul;33(1):27-48.
Duranton F, Cohen G, De Smet R, Rodriguez M, Jankowski J, Vanholder R, Argiles A; European Uremic Toxin Work Group.
Normal and pathologic concentrations of uremic toxins.
J Am Soc Nephrol. 2012 Jul;23(7):1258-70. Epub 2012 May 24.
Mullen W, Delles C, Mischak H; members of EuroKUP COST action.
Urinary proteomics in the assessment of chronic kidney disease.
Curr Opin Nephrol Hypertens. 2011 Nov;20(6):654-61.
Mischak H, Thongboonkerd V, Schanstra JP, Vlahou A
Renal and urinary proteomics.
Proteomics Clin Appl. 2011 Jun;5(5-6):211-3. doi: 10.1002/prca.201190031.
Zürbig P, Dihazi H, Metzger J, Thongboonkerd V, Vlahou A
Urine proteomics in kidney and urogenital diseases: Moving towards clinical applications.
Proteomics Clin Appl. 2011 Jun;5(5-6):256-68. doi: 10.1002/prca.201000133. Epub 2011 May 18.
Foucher C, Schiffer E, Mischak H, Ansquer JC, Wilbraham D
Effect of fenofibrate treatment on the low molecular weight urinary proteome of healthy volunteers
Proteomics Clinical Applications 2011
Good DM, Zürbig P, Argilés A, Bauer HW, Behrens G, Coon JJ, Dakna M, Decramer S, Delles C, Dominiczak AF, Ehrich JHH, Eitner F, Fliser D, Frommberger M, Ganser A, Girolami MA, Golovko I, Gwinner W, Haubitz M, Herget-Rosenthal S, Jankowski J, Jahn H, Jerums G, Julian BA, Kellmann M, Kliem V, Kolch W, Krolewski AS, Luppi M, Massy Z, Melter M, Neusüss C, Novak J, Peter K, Rossing K, Rupprecht H , Schanstra JP, Schiffer E, Stolzenburg JU, Tarnow L, Theodorescu D, Thongboonkerd V, Vanholder R, Weissinger EM, Mischak H, Schmitt-Kopplin P
Naturally occurring human urinary peptides for use in diagnosis of chronic kidney disease.
Mol Cell Proteomics. 2010 Nov;9(11):2424-37. Epub 2010 Jul 8.
Kistler A, Mischak H, Poster D, Dakna M, Wuthrich R, Serra A
Identification of a unique urinary biomarker profile in autosomal dominant polycystic kidney disease
Kidney Int. 2009 Jul;76(1):89-96
Mischak H, Massy ZA, Jankowski J
Proteomics and uremia and renal disease
Semin Dial. 2009 Jul-Aug;22(4):409-16.
Zürbig P, Decramer S, Dakna M, Jantos J, Good DM, Coon JJ, Bandin F, Mischak H, Bascands JL, Schanstra JP.
The human urinary proteome reveals high similarity between kidney aging and chronic kidney disease.
Proteomics. 2009 Apr;9(8):2108-17
Haubitz M, Good DM, Woywodt A, Haller H, Rupprecht H, Theodorescu D, Dakna M, Coon J, Mischak H
Identification and Validation of Urinary Biomarkers for Differential Diagnosis and Evaluation of Therapeutic Intervention in ANCA associated Vasculitis
Mol Cell Proteomics. 2009 Oct;8(10):2296-307. Epub 2009 Jun 28.
Haubitz M, Mischak H, Julian BA, Novak J
Urinary Protein Patterns as a Diagnostic Tool for Patients with Immunoglobulin A Nephropathy
European Renal Disease - Touch Briefings 2008
Schiffer E, Mischak H, Vanholder RC
Exploring the uremic toxins using proteomic technologies
Contrib Nephrol. 2008, 160: 159-171
Zurbig P, Mischak H
Capillary electrophoresis coupled to mass spectrometry for biomarker discovery and diagnosis of kidney diseases
Contrib Nephrol. 2008, 160: 107-126
Raedler T, Wittke S, Jahn H, Kössler A, Mischak H, Wiedemann K
Capillary electrophoresis mass spectrometry as a potential tool to detect lithium-induced nephropathy: Preliminary results
Prog Neuropsychopharmacol Biol Psychiatry 2008, 32(3): 673-678
Julian BA, Wittke S, Novak J, Good D, Coon JJ, Kellmann M, Zurbig P, Schiffer E, Haubitz M, Moldoveanu Z, Calcatera S, Wyatt R, Sykora J, Sladkova E, Hes O, Mischak H, Mc Guire B
Electrophoretic methods for analysis of urinary polypeptides in IgA-associated renal diseases
Electrophoresis 2007, 28(23): 4469-4483
Julian BA, Wittke S, Haubitz M, Zurbig P, Schiffer E, McGuire BM, Wyatt RJ, Novak J
Urinary biomarkers of IgA nephropathy and other IgA-associated renal diseases
World Journal of Urology 2007, 35(5): 467-476
Fliser D, Novak J, Thongboonkerd V, Argiles A, Jankowski V, Girolami MA, Jankowski J, Mischak H
Advances in urinary proteome analysis and biomarker discovery
J Am Soc Nephrol. 2007, 18(4): 1057-1071
Walden M, Wittke S, Mischak H, Vanholder RC
Proteomics of human dialysate and ultrafiltrate fluids yielded by renal replacement therapy
Thongboonkerd V (Ed.) 2006, Proteomics of Human Body Fluids: Principles, Methods, and Applications
Haubitz M, Wittke S, Weissinger EM, Walden M, Rupprecht HD, Floege J, Haller H, Mischak H
Urine protein patterns can serve as diagnostic tools in patients with IgA nephropathy
Kidney Int. 2005, 67(6): 2313-2320
Hillman M, Mischak H
CE-MS as a Tool for Renal Disease Analysis and Biomarker Discovery Pace Setter
The worldwide newsletter for capillary electrophoresis (Beckman Coulter) 2005, 9(2): 1-5
Weissinger EM, Kaiser T, Meert N, De Smet R, Walden M, Mischak H, Vanholder RC
Proteomics: a novel tool to unravel the patho-physiology of uraemia
Nephrol Dial Transplant. 2004, 19(12): 3068-3077
Weissinger EM, Wittke S, Kaiser T, Haller H, Bartel S, Krebs R, Golovko I, Rupprecht HD, Haubitz M, Hecker H, Mischak H, Fliser D
Proteomic patterns established with capillary electrophoresis and mass spectrometry for diagnostic purposes
Kidney Int. 2004, 65(6): 2426-2434
Haubitz M, Fliser D, Haller H
Proteomanalyse – eine neue Perspektive für die klinische Diagnostik
Deutsches Ärzteblatt 2004, 101(21): A-1514 / B-1255 / C-1207
Weissinger EM, Mischak H
Proteom analysis applied towards early diagnosis of renal diseases and transplant-monitoring
Transplantationsmedizin 2004, 16: 2-9
